转载需获取授权,欧博abg请与小编联系
全文约2000字,预计阅读6分钟
截至2024年12月31日,国内共有56家企业(不含子公司)的106款干细胞药物临床试验申请获得受理,欧博官网其中12月新增2款。共有44家企业(不含子公司)的79款获准默许进入临床试验(临床试验默示许可),其中12月新增4款。106款受理干细胞药物中有15款已无法查到IND评审信息或评审暂停(12月新增2款),14款正在评审中。2023年全年共有47款干细胞药物临床试验申请获得受理,欧博35款获准默许进入临床试验(临床试验默示许可);2022年全年共有29款干细胞药物临床试验申请获得受理,26款获准默许进入临床试验(临床试验默示许可)。
新增受理1:2023年12月14日,北京瑷格干细胞科技有限公司的“人脂肪间充质干细胞注射液”的物临床试验申请获受理(受理号为:CXSL2300857)。这是该款细胞注射液的第3种适应证获得受理,欧博娱乐此前已获得默示许可用于系统性硬化症手部皮肤纤维化导致的手功能障碍(挛缩)(受理号:CXSL2300204)和局灶性硬皮病头面部及四肢皮肤硬化(受理号:CXSL2300630)。
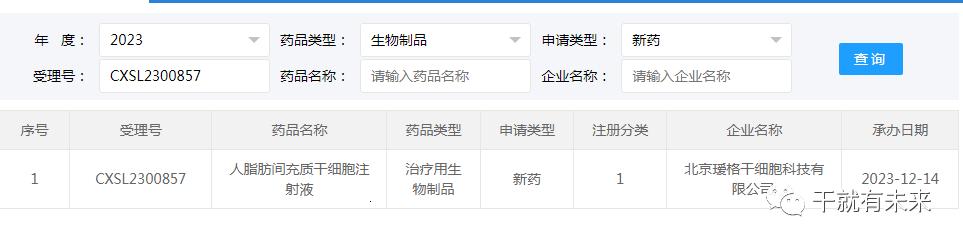
▲图片来源:CDE官网
新增受理2:2023年12月30日,广州赛隽生物科技有限公司的“CG-BM1异体人骨髓间充质干细胞注射液”的物临床试验申请获受理(受理号为:CXSL2300909)。这是该款细胞注射液的第3种适应证获得受理,此前已获得默示许可用于感染引起的中重度成人急性呼吸窘迫综合征(ARDS)(受理号:CXSL2101334)和慢加急性肝衰竭(ACLF)(受理号:CXSL2200505)。
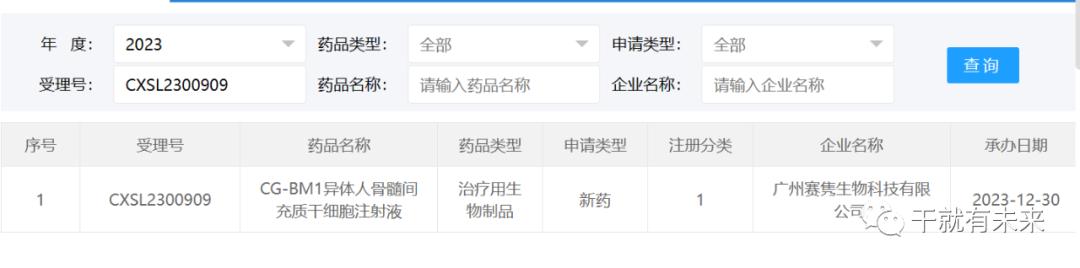
▲图片来源:CDE官网
新增默示许可1:睿健医药科技(苏州)有限公司;武汉睿健医药科技有限公司的“人源多巴胺能前体细胞注射液”(iPSC衍生药物)(受理号:CXSL2300628)获得新药临床试验默示许可,适应证:发病年龄早于50岁的早发型帕金森病。此前,该款干细胞制剂已默示许可用于1种适应证的临床试验:帕金森病(CXSL2100023)。

▲图片来源:CDE官网
新增默示许可2:北京瑷格干细胞科技有限公司的“人脂肪间充质干细胞注射液”(受理号:CXSL2300630)获得新药临床试验默示许可,适应证:局灶性硬皮病头面部及四肢皮肤硬化。此前,该款干细胞制剂已默示许可用于系统性硬化症手部皮肤纤维化导致的手功能障碍(挛缩)(CXSL2300204)。

▲图片来源:CDE官网
新增默示许可3:贵州中观生物技术有限公司的“人脐带间充质干细胞注射液”(受理号:CXSL2300664)获得新药临床试验默示许可,适应证:早期(ARCO I期或II期)非创伤性股骨头坏死。此前,该款干细胞制剂已默示许可用于膝骨关节炎(CXSL2200145)。

▲图片来源:CDE官网
新增默示许可4:杭州易文赛生物技术有限公司的“人脐带间充质干细胞注射液”(受理号:CXSL2300670)获得新药临床试验默示许可,适应证:中重度特应性皮炎。此前,该款干细胞制剂已默示许可用于中、重度急性呼吸窘迫综合征(CXSL2300221)。
